서 론
재료 및 방법
1. 공시시료
2. Biochemical methane potential (BMP) 시험
3. 분석모델 (Modified Gompertz model, Parallel first order kinetics model)
4. 반응속도 분석
5. 분석 방법
결과 및 고찰
1. Biochemical methane potential test
2. Maximum methane production rate
결 론
서 론
현대 사회에서 음식물류 폐기물 처리는 매우 중요한 사회적, 환경적 문제로 인식되고 있다. 세계적으로 낭비되는 음식물류 폐기물은 매우 상당한 규모를 차지하며, 이는 자원의 낭비와 환경 오염으로 이어질 수 있다. 현재 국내에서는 연간 516만 톤의 음식물류 폐기물이 발생되고 있으며, 이 중 95% 이상이 사료나 퇴비화 등의 방법으로 사용되고 있다 (ME, 2021). 또한 음식물류 폐기물 탈수 과정에서 상당한 양의 음폐수가 발생되고 있다. 이렇게 발생한 음폐수는 가축분뇨와 하수슬러지에 비해 유기물 함량이 높고 분해속도가 빨라 혐기 소화에 훌륭한 생산 원료이다 (Kim et al., 2024). 또한 가축분뇨와 혼합하여 혐기 소화 시 별도의 폐수처리 없이 생성된 소화액을 농경지 비료로 활용할 수 있으며, 재생에너지 자원으로 순환 활용에 있어서 합리적이고 경제적인 실행 가능성 있는 자원이다 (KEITI, 2016).
바이오가스는 유기성 폐자원을 활용하여 생산되는 친환경적인 에너지원으로 주목받고 있다. 바이오가스는 주로 혐기성 발효 과정인 혐기 소화를 통해 생산되며, 이는 음폐수, 농축산 폐기물 등의 다양한 유기성 폐기물을 처리하는 과정에서 발생된다. 혐기 소화는 혐기성 미생물이 유기물을 메탄으로 전환시키는 생물학적 처리 방법이다. 이 과정은 산소가 없는 혐기성 조건에서 일련의 가수분해, 산 생성, 아세트산 생성 및 메탄 생성 반응을 통해 발생한다 (Meegoda et al., 2018). 이 복잡한 공정에서 혐기성 미생물은 합성 (교차 공급) 방식으로 작동하며, 여기서 한 미생물 반응의 생성물은 후속 미생물 반응의 기질 역할을 한다. 특히, 아세트산 생산 미생물과 메탄 생성 미생물 사이의 영양적 상호작용 측면에서 공생 관계는 혐기성 소화조의 작동 안정성을 향상시키는 데 중요한 역할을 한다. 이러한 공생영양 (syntrophy, cross feeding)은 혐기성 미생물의 활성을 높이는 동시에 메탄 생성 미생물과 아세트산 생산 미생물 간의 전자전달의 평형을 유지하는 단계를 의미하며 종간간접전자전달 (IIET, Indirect Interspecies Electron Transfer)이라고 한다 (Baek et al., 2019). 하지만 혐기 소화에 있어서 환경 조건의 변화는 바이오가스 생산에 큰 영향을 미치는데, 이 요소로는 낮은 pH, 온도, 유기물 부하율(OLR, organic loading rate), 높은 휘발성 지방산 (VFA, volatile fatty acid) 농도 그리고 높은 염분 (Na+, Ca2+, K+, Mg2+)등이 있다 (Yeo et al., 2023).
최근 연구에서는 음폐수를 혐기 소화조에 투입하였을 때 혐기성 미생물 간의 반응속도의 불균형으로 인해 pH 저하 및 VFA 축적이 발생하여 소화조 내 환경이 크게 변해 IIET 메커니즘에 문제가 발생할 수 있다고 하였다 (Kim et al., 2023; El-Qelish et al., 2023; Lee et al., 2022). 최근 종간간접적전자전달이 아닌 종간직접전자전달 (DIET, direct interspecies electron transfer)에 의해 유기물 부하율이 높은 혐기 소화의 효율을 증진시킨다는 연구가 보고되고 있다 (Morite et al., 2011; Rotaru et al., 2014; Baek et al., 2018). DIET는 전자전달을 위한 매개체가 필요한 IIET와 다르게 혐기 소화조 내에 전도성 물질을 투입하여 아세트산 생성 미생물과 메탄 생성 미생물간의 직접적인 전자 전달 반응을 촉진시켜 혐기 소화 효율을 향상시키는 기술이다 (Lee et al., 2023). DIET을 촉진하는 전도성 물질은 철계 물질 (magnetite, hematite, goethite, ferrihydrite etc.)과 탄소계 물질 (GAC, biochar, carbon cloth, graphite, etc.) 등이 있다. 철계 전도성 물질에 해당하는 magnetite (Fe3O4)는 전도도가 높은 물질로 혐기 소화에 투입할 경우 혐기 소화의 DIET 효율이 향상되는 것으로 보고되고 있다 (Kato et al., 2012; Zhao et al., 2015; Zhuang et al., 2015). 전도성 물질을 투입한 혐기 소화 연구에서는 음폐수, 가축 배설물, 하수 슬러지 등 원료와 전도성 물질의 종류, 투입 농도에 따라 혐기 소화 효율이 상이하며, 일정량 이상의 농도에서는 가수분해, 산 생성 단계, 아세트산 생성 단계의 과도한 가속화로 인해 메탄 생성이 억제되기도 하는 보고가 있다 (Moreno et al., 2020; Corona et al., 2021; Li et al., 2019).
하지만 현재 보고된 연구 중에서는 DIET를 첨가하지 않고 혐기 소화에 음폐수를 기질로 이용하였을 때 메탄 생성 효과가 증진하거나 반대로 초기 저해 반응이 일어나는 연구가 보고되고 있다 (Kim et al., 2024; Baek et al., 2018; Lee et al., 2022). Lisa, 등 (2008)은 고농도의 음식물류 폐기물 및 음폐수는 높은 나트륨과 강한 산성으로 인하여 바이오가스 생산에 저해를 일으킨다고 하였다. 하지만 충분한 적응성을 거친 소화조의 경우 미생물들이 나트륨 독성에 적응하여 내성이 생길 수 있다고 한다. Hu 등 (2020)은 혐기 소화에서 음폐수 적응 시 혼합 메탄균이 산성화로 인하여 감소하고 hydrogentrophic 메탄균이 우점하였다고 보고하였다. Rui 등 (2024)는 혐기 소화 중 DIET 물질을 첨가하였을 때 acetoclastic 메탄균보다 hydrogentrophic이 우점한다고 보고하였다. 따라서 본 연구에서는 음폐수만을 기질로 이용하여 운전된 혐기 소화조 내의 소화액을 접종액으로 이용하여 혐기 소화에 음폐수만을 기질로 이용하였을 때 magnetite 첨가 농도에 따라 최대 메탄 생산 속도와 최대 메탄 생산 속도에 도달하는 반응 속도를 분석하여 magnetite가 혐기 소화 초기에 미치는 메탄 수율과 반응속도 영향을 평가하고자 하였다.
재료 및 방법
1. 공시시료
본 연구에서 BMP test의 기질로 이용한 음폐수는 경기도 이천시 바이오가스 연구 시설의 음식물류 폐기물 처리시설에서 채취하였으며, 채취한 음폐수의 이화학적 성상은 Table 1과 같다. 본 연구에서 사용한 음폐수는 SCODCr/CODCr의 비율이 66.02%로 산출되어 대부분의 유기물 형태가 용해성 유기물로 존재하는 것으로 나타났다.
Table 1.
Chemical composition of food wastewater and inoculum.
| Parameter | Food wastewater | Inoculum | ||
| pH | - | 3.54 | 7.72 | |
| TS1 | mg/L | 113,575 | 25,298 | |
| VS2 | 91,572 | 12,116 | ||
| TKN3 | 3,875 | 9,252 | ||
| NH4+-N4 | 340 | 6,123 | ||
| CODCr5 | 164,133 | 31,683 | ||
| SCODCr6 | 108,367 | 22,322 | ||
| TVFA7 | as acetate | 14,296 | 10,401 | |
| Alkalinity | as CaCO3 | - | 34,300 | |
2. Biochemical methane potential (BMP) 시험
본 연구에서 사용한 접종액은 한경국립대학교에서 음폐수를 유입 기질로 투입하고 HRT (hydraulic retention time) 30일로 운전 중인 20 L 규모의 중온 (38℃) PFR (plug-flow reactor) 혐기 소화조에서 채취하였다. 채취한 접종액은 중온 (38℃) 조건의 혐기 반응기에서 2주간 배양하여 접종액 내 잔여 유기물과 가스를 제거한 후 BMP 시험에 사용하였으며, 접종액의 이화학적 성상은 Table 1과 같다. BMP 시험에 사용한 회분식 반응기는 160 mL serum bottle을 이용하였으며, 반응기에 접종액 75mL를 분주한 상태에서 음폐수를 투입하였다. 음폐수의 투입량은 음폐수와 접종액의 휘발성 고형물의 비율 (S/I Ratio)이 0.7이 되도록 하였다. DIET 전도체로서 자철석 (magnetite; Fe3O4) 분말 (직경 5μm 이하, Samchun, CAS NO : 1317-61-9)의 투입농도는 유효용량을 기준으로 10, 20, 30, 60, 120, 150 mM (0.23, 0.46, 0.69, 1.39, 2.78, 2.85 g/L) 투입하였다. Magnetite를 첨가하지 않은 것은 무처리구 (control)를 설정하였으며, 접종액 자체의 발생 바이오가스를 보정하기 위해 바탕 시험을 운영하였다. 바탕 시험, 무처리구 그리고 magnetite 처리구는 3 반복으로 진행하였다. 회분식 반응기는 head space를 N2 가스로 충전 후, 혐기성 상태를 유지하기 위해 blue butyl rubber stopper과 aluminum crimp seal로 완전밀폐 시켜 38℃의 혐기 반응기에서 1일 1회 교반을 시켰으며 75일 동안 혐기 소화를 진행하였다. 바이오가스 발생량 측정은 수주차식 가스량 측정기를 사용하였으며 발생 바이오가스는 식 (1)과 같이 온도와 수분을 보정하여 표준상태 (0℃, 1기압)에서의 건조 가스 부피로 환산하여 누적 메탄 생산곡선을 구하였다. 식 (1)에서 Vdry gas는 표준상태 (0℃, 1기압)에서의 건조 가스의 부피, T는 반응기의 운전온도, Vwet gas at T℃는 반응기 운전온도 (38℃)에서의 습윤 가스의 부피, P는 가스의 부피측정 당시의 대기압, PT는 T℃에서의 포화수증기압 (mmHg)이며, 본 연구에서는 P를 760 mmHg로 간주하고 PT는 38℃에서의 포화수증기압으로 계산하였다 (Oh and Yoon, 2017).
4. 분석모델 (Modified Gompertz model, Parallel first order kinetics model)
Modified Gompertz model은 누적 메탄 생산 곡선으로 지체성장기, 대수증식기, 정체성장기를 거치는 혐기 미생물의 성장특성과 메탄 생산 특성을 설명할 수 있다. 식 (2)에서 M은 누적 메탄 생산량 (mL), t는 혐기 소화 기간 (days), P는 최종메탄 생산량 (mL), e는 exp(1), Rm은 최대 메탄 생산 속도 (mL/day), λ는 지체성장시간 (days)을 의미한다 (Lee and Yoon, 2022).
5. 반응속도 분석
본 연구에서 BMP 시험 반응속도 (Reaction kinetics)는 시간에 따른 누적 메탄 생산곡선 [P(t)]으로 분석하였다. 누적 메탄 생산곡선 [P(t)]은 시간 (t)에 따른 누적 메탄 생산량 (P) 간의 함수를 나타낸다. 이때, P(t) 함수의 1차 미분식 [P’(t)]는 반응시간 (t)에서의 메탄 생산 속도 [R(t)]를 나타낸다. 또한, P(t) 함수의 2차 미분식 [P’’(t)]은 메탄 생산가속도를 의미하며, P’’(t)가 ‘0’이 되는 지점에서의 시간(t0)은 최대 메탄 생산 속도에 도달하는 기간 (day)을 나타낸다. 이때 P’(t0)를 최대 메탄 생산 속도 [Rm(t0)]로 정의하였다.
6. 분석 방법
바이오가스 농도 분석은 TCD (Thermal conductivity detector)가 장착된 Gas chromatography (GC 2023, Shimazue, USA)를 이용하였다. 컬럼은 Hayesep Q packed columm (Porapak-Q, 1.8 m × 2 mm i.d., 80/100 mesh size)을 이용하였으며, 고순도 아르곤 (Ar) 가스를 이동상으로 사용하여 flow 20 mL/min의 운전 상태에서 주입부 (Iinjector) 온도 150℃, 컬럼부 (column oven) 75℃, 검출부 (detector) 150℃에서 분석하였다 (Sørensen et al., 1991). 시료의 이화학적 성상분석은 총 고형물 (total solid, TS), 휘발성 고형물 (volatile solid, VS), 화학적 산소 요구량 (chemical oxygen demand, CODCr), 용해성 화학적 산소 요구량 (soluble chemical oxygen demand, SCODCr), 총 킬달 질소 (total Kjeldahl nitrogen, TKN), 암모니아성 질소 (ammonium nitrogen, NH4+-N), 알칼리도 (alkalinity), 휘발성 지방산 (total volatile fatty acids, TVFAs) 등은 표준분석법 (Rice et al., 2012)에 따라 수행하였다. 혐기 소화 반응온도에 따른 유기물 분해 특성 분석모델은 SigmaPlot (SigmaPlot Version 12.5, Systat Software Inc., USA)으로 modified Gompertz model과 parallel first order kinetics model을 이용하였다 (Lay et al., 1998).
또한, 본 실험 결과에 대한 통계분석은 SASⓇ program package (SAS ver. 9.4, SAS institute Inc, North Carolina, USA)의 GLM (general linear model) procedure를 이용하여 분석하였으며, DIET 효과를 위한 magnetite 첨가 수준에 따른 생화학적 메탄 퍼텐셜과 COD 제거율의 선형, 이차 및 삼차 효과를 분석하기 위해 직교 다항 비교(orthogonal polynomial contrast)를 시행하였고 처리간 유의성 (p<0.05)은 Duncan’s multiple range test를 통하여 검정하였다 (Duncan 1995).
결과 및 고찰
1. Biochemical methane potential test
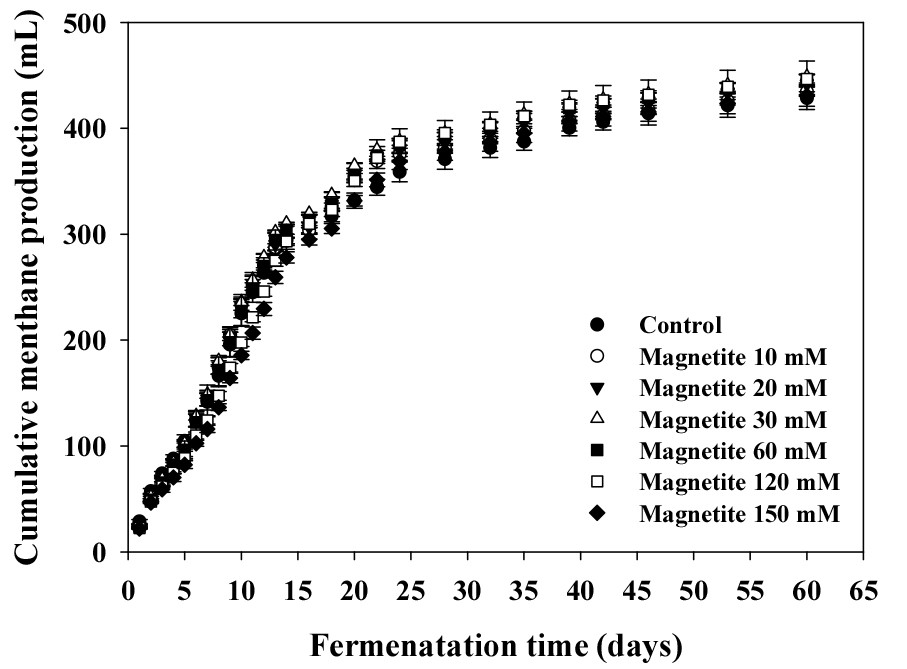
BMP test를 통하여 음폐수에 적응된 접종액에 음폐수를 기질로 하였을 때 magnetite 농도에 따른 생화학적 메탄 퍼텐셜, COD 제거율 그리고 누적 메탄 발생량을 Table 2와 Figure 1에 나타내었다. Magnetite의 첨가 수준을 120 mM까지 증가하였을 때 생화학적 메탄 퍼텐셜이 증가하였으나, 150 mM 첨가수준에서는 감소하였다 (p<0.05). 그리고 10 mM과 150 mM 첨가를 제외하고 모든 처리구는 control에 비해 증가하였다 (p<0.05). Lee et al., (2023 a)의 음폐수를 기질로 이용한 BMP test에서 0.25, 0.50, 1.00, 1.50 % magnetite를 투입하였을 때 1.00 % 투입한 처리구에서 가장 큰 생화학적 메탄 퍼텐셜이 나타났으며, magnetite를 1.50 % (43 mM)까지 첨가량을 증가시켰을 때 생화학적 메탄 퍼텐셜은 감소하는 것으로 나타났다. Zhang et al., (2019)는 돈분 슬러리를 이용한 BMP test에서 magnetite를 5-350 mM 참가하였을 때 대조구에 비해 혐기 소화 효율은 16.1 % 증가하였지만 유의적인 차이는 없었다고 보고하였으며, 이는 magnetite 투입 시 분산성이 낮아져 magnetite에 미생물들이 붙어 전자전달을 진행하는 비표면적이 낮아진 것으로 생각되며 이에 따라 효과를 확인하기 어려웠을 것으로 보인다고 보고하였다. 본 연구 결과들과 비교하였을 때 magnetite의 첨가 수준이 일정 수준까지 투입하였을 때 생화학적 메탄 퍼텐셜이 증가하는 것으로 나타났으며, Kim et al., (2024)은 혐기 소화에 있어서 magnetite 첨가 시 기질의 차이에 따라 효과가 다르게 나타날 수 있다고 하였다. 각 처리구의 COD 제거율(VSr)은 20-120 mM 첨가 처리구가 control에 비해 5.27, 6.90, 7.44, 8.30% 증가하는 것으로 나타났으며 (p<0.05), 이는 생화학적 메탄 퍼텐셜과 동일하게 0-120 mM 으로 첨가 수준이 늘어남에 따라 증가하였으며, 150 mM 첨가하였을 때 감소하였다 (p<0.05). 그리고 10 mM 과 150 mM 수준에서는 control 보다는 수치적으로는 증가하지만 유의적인 차이는 없었다. Yin et al., (2017)는 magnetite를 10g/L 유기탄소원을 이용한 연속식 반응기에 투입하였을 때 COD 제거율이 23.8 % 증가한 것으로 나타났다. Kassab et al., (2020)은 음폐수를 기질로 활용한 회분식 혐기 소화조에 magnetite를 25, 50, 80 mg/L로 투입하였을 때 COD 제거율이 대조구에 비해 모두 높게 나타났으며, 최대 50% 이상의 효율이 증가했다고 보고하였다. 선행 연구 결과들과 본 연구 결과들을 종합하였을 때 magnetite를 첨가하는 것이 첨가 수준과 관계없이 수치적으로 COD 제거율은 증가하지만 유의적인 효율을 위해서는 특정 첨가 수준으로 투입해야할 것으로 생각된다.
Table 2.
Methane yield by concentration according to the addition of magnetite.
| Parameters | CON3 | Magnetite (mM) | p-value | SEM4 | Contrast5 | ||||||||
| 10 | 20 | 30 | 60 | 120 | 150 | L | Q | C | |||||
| Bu1 |
Nm3/kg -CODadded | 0.277c | 0.287bc | 0.293ab | 0.298ab | 0.301ab | 0.304a | 0.291abc | 0.033 | 0.005 | 0.048 | 0.003 | 0.805 |
| VSr2 | % | 79.02c | 82.03bc | 83.61ab | 85.27ab | 85.87ab | 86.86a | 83.10abc | 0.033 | 1.477 | 0.048 | 0.003 | 0.805 |
1Biochemical methane potential, 2Ratio of degradation (Bu-COD/Bth(theoretical methane potential)), 3CON: Control, 4SEM : Standard error mean, 5Contrast (L: Linear effects, Q: Quadratic effects, C: Cubic effects), abcMean with different letter differ significantly between treatment (p<0.05), Magnetite concentration.
2. Maximum methane production rate
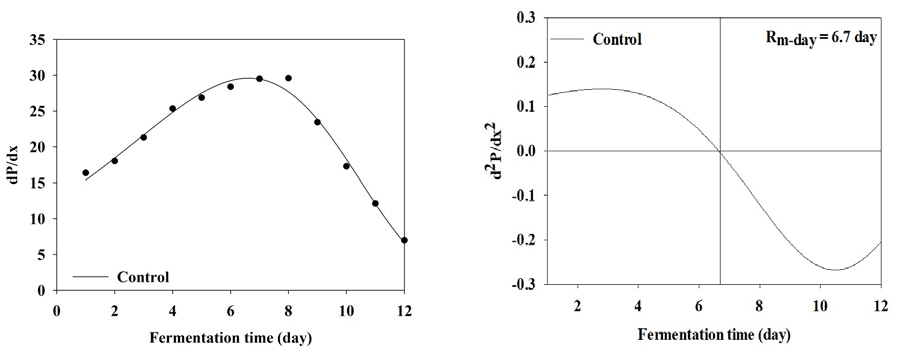
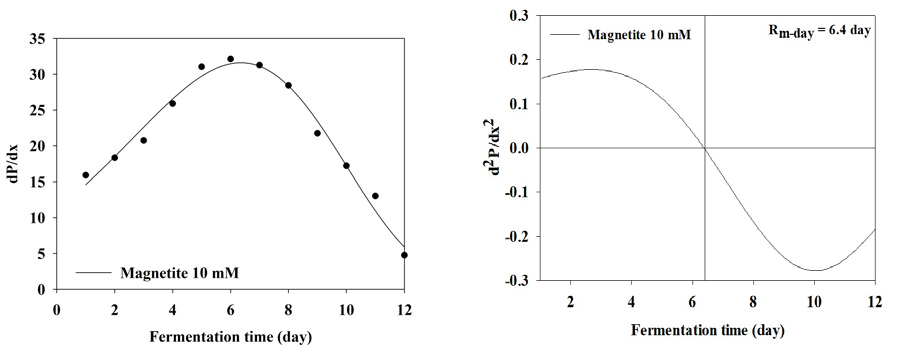
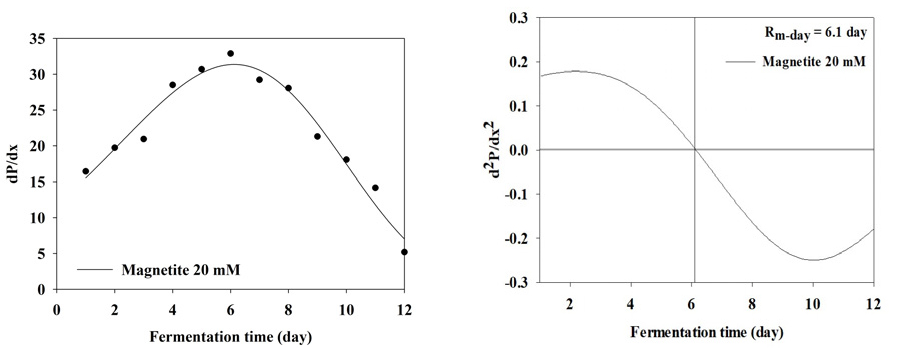
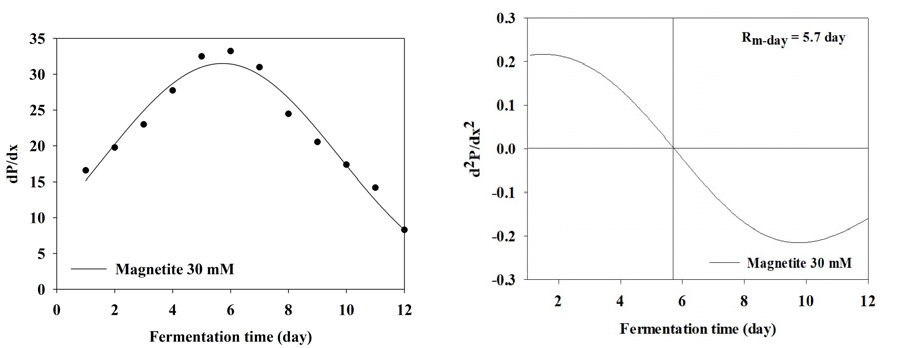
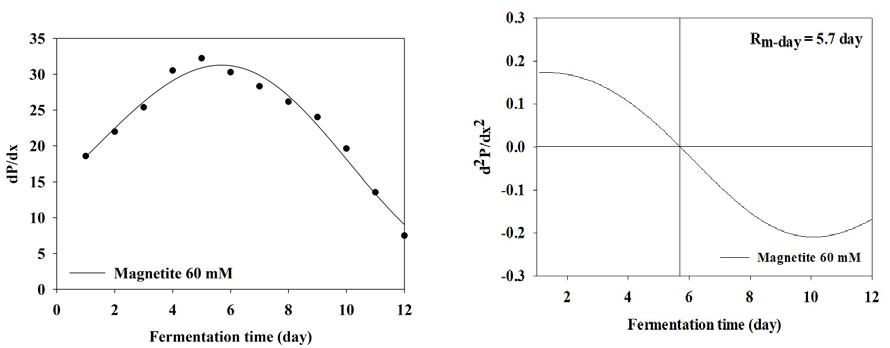
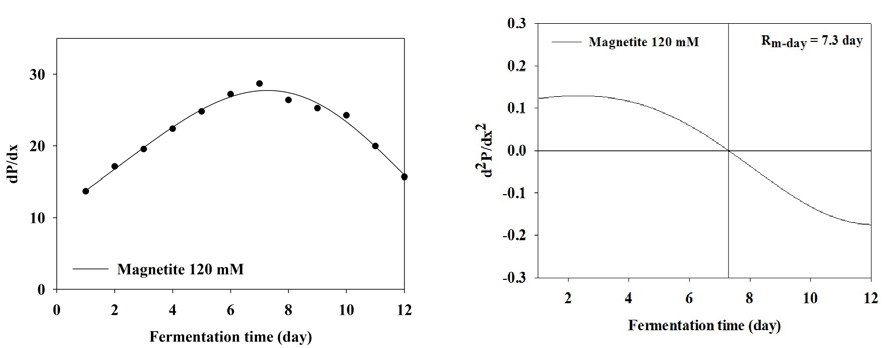
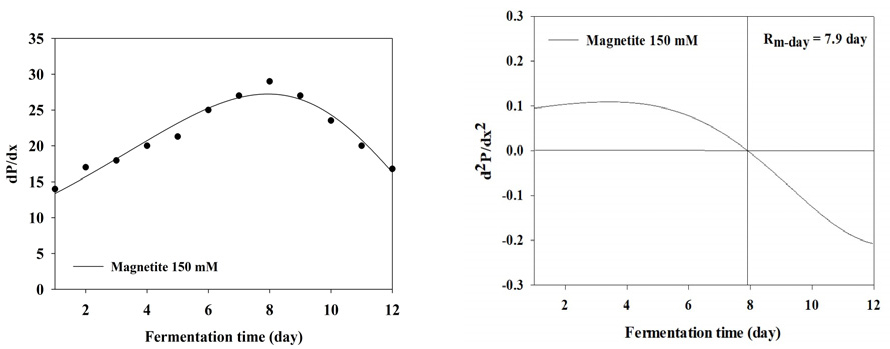
BMP test 결과 누적 메탄 생산 곡선을 1차 미분식과 2차 미분식을 이용하여 일일 최대 메탄 생산량 (Rm(t0))와 최대 메탄 생산 속도에 도달하는 기간을 분석한 결과는 Table 3와 Figure 2, 3, 4, 5, 6, 7, 8에 나타내었다. Control과 모든 처리구들의 일일 최대 메탄 생산량는 29.59, 31.60, 31.37, 31.51, 31.27, 27.74, 27.23 mL/day로 나타났다. Magnetite 10, 20, 30, 60 mM 첨가 시 control에 비해 2.01, 1.78, 1.92, 1.68 mL/day만큼 증가하였지만, 120, 150 mM 첨가 처리구는 control에 비해 1.85, 4.59 mL/day만큼 감소하였다. 회귀분석 결과 magnetite 0-30 mM 첨가까지 linear하게 증가하였고, 60-120 mM 첨가 시 quadratic하게 감소하다가 150 mM 이후로 다시 cubic하게 증가하는 결과가 나타났다 (p<0.05). 최대 메탄 생산 속도 도달일 (t0)은 6.7, 6.4, 6.1, 5.7, 5.7, 7.3, 7.9 day로 나타났으며, 최대 메탄 생산량과 동일하게 magnetite 10, 20, 30, 60 mM 첨가 처리구가 control에 비해 4.48, 8.96, 14.93, 14.93% 증가하는 것으로 나타났으며, 120과 150 mM 처리구는 각 8.96, 26.87% 감소하는 것으로 나타났다. Kassab et al., (2020)은 음폐수를 기질로 투입한 회분식 BMP 실험에서 magnetite를 낮은 농도에서 첨가하였을 때 대조구와 메탄 생산량이 차이가 발생하지 않았지만, 농도가 올라갈수록 메탄 발생량 속도가 증가하였으며, 배양 초기에 최대 메탄 생산 속도가 대조구에 비해 25, 50, 80 mg/L의 magnetite를 첨가하였을 때 2.8, 5.4, 5.9일씩 감소하지만 이후부터는 가속화 되어 일일 최대 메탄 생산량이 45.2% 증가하였다고 보고하였다. Yin et al., (2017)은 magnetite를 40 mM 투입하고 유기탄소원을 기질로 이용하였을 때 대조구에 비해 최대 메탄 생산 속도가 6.2% 증가하였다고 보고하였다. 또한 Kim et al., (2023)은 음폐수를 기질로 진행한 BMP test에서 magnetite를 5-100 mM까지 투입하였을 때 100 mM을 제외하고 투입량이 증가할수록 메탄 퍼텐셜 증가와 최대 메탄 생산 속도의 가속화가 지속적으로 이루어졌다고 보고하였다. Lee et al., (2023 b)은 돈분과 음폐수를 이용한 통합 혐기 소화조에서 채취한 소화액을 접종액으로 하고 음폐수를 기질로 하였을 때 magnetite를 0-100 mM로 첨가하였을 때 일일 최대 메탄 생산량과 최대 메탄 생산 속도를 조사하였으며, magnetite 투입량이 증가할수록 메탄 퍼텐셜과 최대 메탄 생산 속도가 증가한다고 하였으며, 최대 메탄 생산 속도가 14.67-21.25 day로 나타났다. 본 연구에서는 magnetite의 DIET 효과로 최대 메탄 생산 속도가 5.7-7.3 day로 나타난 것과 비교하였을 때 약 3배 정도의 속도 차이를 확인할 수 있었으며, 이는 음폐수 적응성에 대한 연구의 차이로 생각된다.
Table 3.
Maximum methane production rates by the different magnetite supplementation concentrations.
| Parameter | Control | Magnetite (mM) | p-value | SEM3 | Contrast4 | ||||||||
| 10 | 20 | 30 | 60 | 120 | 150 | L | Q | C | |||||
| Rm(t0)1 | mL/day | 29.59e | 31.60a | 31.37c | 31.51b | 31.27d | 27.74f | 27.23g | <0.0001 | 0.001 | <0.001 | <0.001 | <0.001 |
| t02 | day | 6.7 | 6.4 | 6.1 | 5.7 | 5.7 | 7.3 | 7.9 | - | ||||
결 론
본 연구는 음폐수에 적응된 접종액에 음폐수를 기질로 이용한 혐기 소화에서 직접 종간 전자 전달 (DIET) 물질인 magnetite의 투입 농도가 미치는 영향을 규명하고자 하였다. Magnetite 투입 농도는 10, 20, 30, 60, 120, 150 mM으로 투입하였으며, BMP test를 통해 메탄 퍼텐셜과 누적메탄 생산곡선을 1차, 2차 미분하여 최대 메탄 발생 속도와 최대 메탄 생산 속도 도달 기간을 분석하였다. 연구결과 magnetite 투입 농도가 20-120 mM까지 증가할수록 control에 비해 생화학적 메탄 퍼텐셜과 COD 제거율이 증가하였다. 하지만 magnetite 120-150 mM을 투입하였을 때 최대 메탄 생산 속도와 최대 메탄 생산 속도 도달일이 control에 비해 감소하는 것으로 나타났다. 따라서, 음폐수만을 기질로 이용하는 바이오가스화플랜트에서 20 mM 이상 60 mM 이하의 magnetite 투입 시 혐기 소화 효율 증진을 기대할 수 있을 것으로 생각된다. 추후 이에 따른, Magnetite 투입에 따른 methanogen과 혐기성 미생물 군집의 변화를 분석하여 혐기 소화 효율 증진에 기여하는 주요 미생물을 규명할 필요가 있으며, 연속식 반응기를 활용한 lab-scale 소화조 운전을 통해 magnetite의 장기적 안정성과 재사용 가능성, 유출로 인한 재투입의 효과를 평가하는 연구가 필요할 것으로 생각된다. 또한, magnetite 입자 크기에 대한 선행 연구 결과가 아직 제한되어 있어 입자 크기에 따른 magnetite 투입 수준의 최적화를 위한 추가적인 연구가 필요할 것으로 판단된다.